Pengertian Tabel Periodik
Apa itu tabel periodik? Pengertian tabel periodik adalah suatu tabel yang menampilkan unsur-unsur kimia. Unsur kimia tersebut memiliki jumlah cukup banyak dengan sifat yang berbeda. Tabel periodik unsur dibuat untuk mengenal nama unsur dari partikel kimia dengan mudah melalui pengelompokkan.
Apa yang dimaksud dengan unsur? Unsur adalah zat yang tidak dapat diuraikan menjadi zat yang lebih sederhana melalui proses kimia biasa. Partikel terkecil dari unsur adalah atom.
Dalam pengelompokan tabel periodik, sifat fisik dan kimia setiap unsur tersebut telah dituangkan para ahli kimia pada tabel unsur. Fungsi tabel periodik unsur adalah untuk membantu mengetahui nomor atom, konfigurasi elektron, dan mempelajari setiap sifat unsur serta keteraturannya.
Tabel tersebut diverifikasi oleh International Union of Pure and Applied Chemistry (IUPAC). Pada sistem tabel ini akan ditemukan golongan dan periode di suatu lajur. Secara umum, golongan adalah lajur vertikal sedangkan periode adalah jalur horizontal.
Berikut adalah istilah-istilah pada tabel periodik yang perlu diketahui agar bisa membacanya dengan baik.
Periode
Pengertian periode adalah baris horizontal pada tabel periodik kimia dengan trend horizontal yang lebih signifikan dibandingkan tren vertikal. Kamu bisa melihat bagian blok-f menunjukan lantanida dan aktinida membentuk dua seri unsur horizontal yang substansial dalam menentukan unsur kimia.
Golongan
Golongan disebut juga dengan istilah famili merupakan bagian tabel periodik yang berbentuk kolom vertikal dengan trend periodik, bukan menggunakan golongan periode atau blok tertentu.
Blok-s
Blok-s pada tabel periodik kimia adalah unsur dua golongan, yakni logam alkali dan alkali tanah. Pada susunanya, blok-s berisi unsur tambahan dengan helium dan hidrogen.
Blok-p
Blok-p pada tabel unsur-unsur kimia terbagi menjadi enam golongan, yakni 13 golongan sampai 18 sesuai dengan ketentuan IUPAC, mulai dari 3A hingga 8A sesuai penamaan Amerika. Semua bagian pada blok-p memiliki kandungan dominan yaitu metaloid.
Blok-d
Blok-d pada tabel unsur-unsur kimia terdiri dari golongan 3 sampai 12, mulai dari golongan 3B hingga 2B menurut sistem penggolongan Amerika. Semua unsur kimia pada golongan blok-d adalah logam transisi.
Blok-f
Blok-f pada tabel unsur-unsur kimia seringnya diletakan di bagian bawah. Perlu diketahui bahwa blok-f tidak memberi nomor golongan yang terdiri dari lantanida dan aktinida.
Pada unsur nomor atom dari hidrogen sampai oganesson sudah disintesis dan disesuaikan dengan penambahan unsur-unsur kimia terbaru.
Unsur kimia nihonium, moscovium, tennessine, dan oganesson adalah unsur baru di tabel periodik ini. Penambahan ini telah dikonfirmasi pada 30 Desember 2015 oleh International Union of Pure and Applied Chemistry (IUPAC) dan kemudian dinamai pada 28 November 2016.
Ada 94 unsur yang muncul secara alami, unsur lainnya dibuat di laboratorium karena tidak ditemukan di alam, seperti sejumlah renik dan disintesis.
Tabel unsur-unsur kimia ini dapat dipakai untuk membaca penurunan hubungan sifat unsur lama dengan sifat unsur baru. Tabel periodik kimia memberikan kerangka kerja unsur kimia untuk membaca dan melakukan analisis perilaku kimia tertentu.
Sejarah Perkembangan Sistem Periodik Unsur
Pengelompokan unsur kimia menurut kemiripan sifat berkembang dari waktu ke waktu. Perkembangan itu dimulai dari Antoine Lavoisier hingga disempurnakan oleh Henry Moseley, kimiawan asal Inggris yang menemukan cara menentukan nomor atom.
Dilansir dari Detik, Moseley telah melakukan eksperimen pengukuran panjang gelombang unsur menggunakan sinar-X pada 1913 seperti ditulis dalam buku “Kimia” karya Nana Sutresna.
Moseley berkesimpulan bahwa sifat dasar tidak didasari oleh massa atom relatif, melainkan oleh kenaikan jumlah proton karena adanya unsur-unsur dengan massa atom berbeda dan jumlah proton yang sama. Unsur tersebut disebut isotop.
Ikatan jumlah proton itu menggambarkan kenaikan nomor atom unsur. Jadi, sifat-sifat unsur adalah fungsi periodik dari nomor atomnya.
Pengelompokan unsur-unsur sistem periodik modern adalah penyempurnaan hukum periodik Mendeleev yang disebut juga sebagai tabel periodik bentuk panjang.
Dalam tabel ini, penyusunan sistem periodik modern disusun berdasarkan kenaikan atom dan kemiripan sifatnya. Sistem periodik modern terdiri dari 7 periode yang kemudian dikelompokkan menjadi periode panjang (periode 4, 5, 6, dan 7) serta periode pendek (1, 2, dan 3).
Terdapat 8 golongan utama (golongan A) dan 8 golongan tambahan (golongan B) pada sistem periodik. Unsur-unsur pada golongan B disebut sebagai logam transisi atau unsur transisi. Letak unsur golongan B berada di antara golongan IIA dan IIIA.
Gambar Tabel Periodik Unsur Kimia
Supaya penjelasan lebih mudah dipahami, berikut adalah tabel sistem periodik lengkap dengan golongan yang diberi nama khusus.
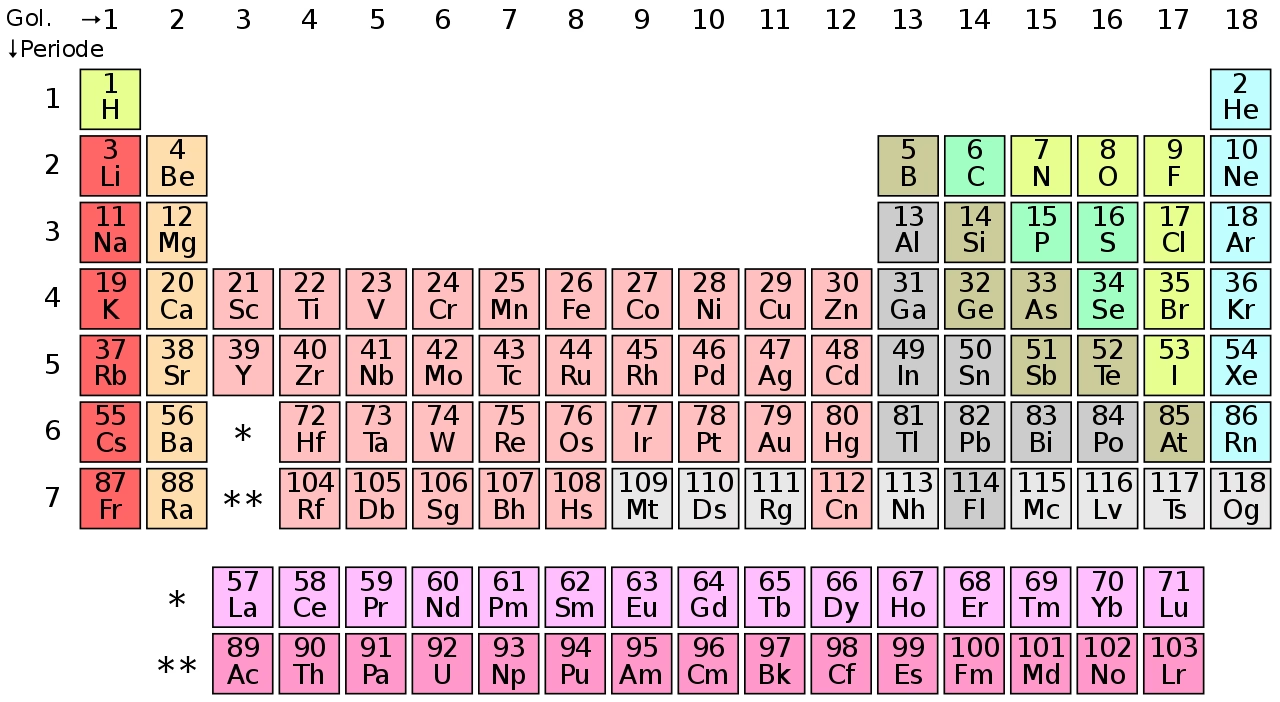
Keterangan
- Tabel ini terdiri dari baris yang menunjukan periode dan kolom yang menunjukan golongan dari unsur-unsur kimia.
- Tabel ini terdiri dari 6 golongan dengan nama dan nomor, misal unsur golongan 17 adalah halogen dan golongan 18 adalah gas mulia.
- Tabel unsur-unsur kimia ini dapat membaca hubungan antar unsur dan memprediksi sifat unsur baru yang akan ditemukan.
- Tabel ini memberikan kerangka kerja untuk menganalisis perilaku unsur kimia tertentu.
| Nomor | Unsur Kimia | Simbol |
|---|---|---|
| 1 | Hidrogen | H |
| 2 | Helium | He |
| 3 | Lithium | Li |
| 4 | Beryllium | Be |
| 5 | Boron B | B |
| 6 | Carbon | C |
| 7 | Nitrogen | N |
| 8 | Oxygen | O |
| 9 | Fluorine | F |
| 10 | Neon | Ne |
| 11 | Sodium | Na |
| 12 | Magnesium | Mg |
| 13 | Aluminum | Al |
| 14 | Silicon | Si |
| 15 | Phosphorus | P |
| 16 | Sulfur | S |
| 17 | Chlorine | Cl |
| 18 | Argon | Ar |
| 19 | Potassium | K |
| 20 | Calcium | Ca |
| 21 | Scandium | Sc |
| 22 | Titanium | Ti |
| 23 | Vanadium | V |
| 24 | Chromium | Cr |
| 25 | Manganese | Mn |
| 26 | Iron | Fe |
| 27 | Cobalt | Co |
| 28 | Nickel | Ni |
| 29 | Copper | Cu |
| 30 | Zinc | Zn |
| 31 | Gallium | Ga |
| 32 | Germanium | Ge |
| 33 | Arsenic | As |
| 34 | Selenium | Se |
| 35 | Bromine | Br |
| 36 | Krypton | Kr |
| 37 | Rubidium | Rb |
| 38 | Strontium | Sr |
| 39 | Yttrium | Y |
| 40 | Zirconium | Zr |
| 41 | Niobium | Nb |
| 42 | Molybdenum | Mo |
| 43 | Technetium | Tc |
| 44 | Ruthenium | Ru |
| 45 | Rhodium | Rh |
| 46 | Palladium | Pd |
| 47 | Silver | Ag |
| 48 | Cadmium | Cd |
| 49 | Indium | In |
| 50 | Tin | Sn |
| 51 | Antimony | Sb |
| 52 | Tellurium | Te |
| 53 | Iodine | I |
| 54 | Xenon | Xe |
| 55 | Cesium | Cs |
| 56 | Barium | Ba |
| 57 | Lanthanum | La |
| 58 | Cerium | Ce |
| 59 | Praseodymium | Pr |
| 60 | Neodymium | Nd |
| 61 | Promethium | Pm |
| 62 | Samarium | Sm |
| 63 | Europium | Eu |
| 64 | Gadolinium | Gd |
| 65 | Terbium | Tb |
| 66 | Dysprosium | Dy |
| 67 | Holmium | Ho |
| 68 | Erbium | Er |
| 69 | Thulium | Tm |
| 70 | Ytterbium | Yb |
| 71 | Lutetium | Lu |
| 72 | Hafnium | Hf |
| 73 | Tantalum | Ta |
| 74 | Tungsten | W |
| 75 | Rhenium | Re |
| 76 | Osmium | Os |
| 77 | Iridium | Ir |
| 78 | Platinum | Pt |
| 79 | Gold | Au |
| 80 | Mercury | Hg |
| 81 | Thallium | Tl |
| 82 | Lead | Pb |
| 83 | Bismuth | Bi |
| 84 | Polonium | Po |
| 85 | Astatine | At |
| 86 | Radon | Rn |
| 87 | Francium | Fr |
| 88 | Radium | Ra |
| 89 | Actinium | Ac |
| 90 | Thorium | Th |
| 91 | Protactinium | Pa |
| 92 | Uranium | U |
| 93 | Neptunium | Np |
| 94 | Plutonium | Pu |
| 95 | Americium | Am |
| 96 | Curium | Cm |
| 97 | Berkelium | Bk |
| 98 | Californium | Cf |
| 99 | Einsteinium | Es |
| 100 | Fermium | Fm |
| 101 | Mendelevium | Md |
| 102 | Nobelium | No |
| 103 | Lawrencium | Lr |
| 104 | Rutherfordium | Rf |
| 105 | Dubnium | Db |
| 106 | Seaborgium | Sg |
| 107 | Bohrium | Bh |
| 108 | Hassium | Hs |
| 109 | Meitnerium | Mt |
| 110 | Darmstadtium | Ds |
| 111 | Roentgenium | Rg |
| 112 | Copernicium | Cn |
| 113 | Ununtrium | Uut |
| 114 | Ununquadium | Uuq |
| 115 | Ununpentium | Uup |
| 116 | Ununhexium | Uuh |
| 117 | Ununseptium | Uus |
| 118 | Ununoctium | Uuo |
Sifat Keteraturan Tabel Periodik
Angka-angka dengan keteraturan sifat unsur menurut jari-jari atom, energi ionisasi, keelektronegatifan, logam dan non-logam, serta afinitas elektron akan ditemukan pada tabel periodik. Berikut adalah istilah-istilah yang berguna untuk lebih memahami tabel periodik.
1. Jari-Jari Atom
Jari-jari atom adalah jarak antara inti atom dan kulit terluar atom. Secara periodik, jari-jari atom dalam satu golongan cenderung makin besar dari atas ke bawah. Itu dapat terjadi karena bertambahnya nomor atom serta kulit elektron dalam satu golongan.
Dalam satu periode, jari-jari atom cenderung semakin kecil dari kiri ke kanan, seperti muatan inti efektif. Makin banyak proton dalam muatan inti efektifnya, makin besar pula gaya tarik inti terhadap elektron terluar.
2. Energi Ionisasi
Ionisasi adalah energi untuk melepaskan elektron terikat paling lemah oleh suatu atom atau ion dalam wujud gas. Secara periodik, energi ionisasi semakin kecil dalam satu golongan dari atas ke bawah. Energi ionisasi cenderung bertambah dalam satu periode dari kiri ke kanan.
Energi ionisasi bergantung pada elektron yang dilepaskan, yaitu besar gaya tarik inti terhadap elektron kulit terluar.
3. Afinitas Elektron
Besarnya energi yang dihasilkan suatu atom ketika menarik sebuah elektron disebut afinitas elektron.
Secara periodik, afinitas elektron cenderung berkurang (semakin kecil) dalam satu golongan dari atas ke bawah, dan cenderung bertambah (semakin besar) dari kiri ke kanan sampai golongan VII A kecuali unsur alkali tanah dan gas mulia.
Semua unsur golongan utama memiliki afinitas elektron bertanda negatif dan unsur golongan terbesarnya dimiliki oleh golongan halogen. Semakin negatif nilai afinitas elektron, maka makin besar kecenderungan atom atau ion menerima elektron. Sehingga, afinitas terhadap elektron semakin besar.
4. Elektronegativitas
Elektronegativitas atau keelektronegatifan suatu unsur adalah sifat yang menyatakan kecenderungan suatu atom menarik pasangan elektron ketika membentuk ikatan. Unsur dengan energi ionisasi dan afinitas elektron yang besar akan membuat keelektronegatifan semakin besar.
Secara periodik, elektronegativitas cenderung akan semakin kecil dalam satu golongan dari atas ke bawah. Sedangkan, dari kiri ke kanan dalam satu periode cenderung makin besar sehingga membuat penarikan atom akan makin mudah.
Nilai keelektronegatifan dapat diukur menggunakan skala Pauling antara 0,7 (Fr) – 4,0 (Fr).
5. Logam dan Non-logam
Sifat logam dan nonlogam adalah kecenderungan atom melepas elektron dan membentuk ion bermuatan positif yang tergantung dengan energi ionisasi.
Logam memiliki sifat keelektropositifan. Semakin besar energi ionisasinya, maka makin berkurang sifat logamnya karena sulit melepas elektron. Sementara itu, sifat non logam berkaitan dengan keelektronegatifan yaitu kecenderungan atom untuk menyerap elektron.
Kecenderungan melepas atau menarik suatu elektron disebut dengan kereaktifan. Unsur logam yang paling reaktif adalah golongan IA. Unsur non-logam paling reaktif berada pada golongan VIIA (lihat sifat logam dan non logam), namun golongan VIIIA (gas mulia) tidak reaktif.
Secara periodik, dalam satu golongan dari atas ke bawah kecil, dan dalam satu periode dari kiri ke kanan dimulai mengecil, dan akan membesar hingga golongan VIIA.
Cara Membaca Tabel Periodik
Kamu yang masih bingung tentang bagaimana cara membaca tabel periodik, simaklah beberapa tips berikut ini.
1. Baca dari Kiri Atas ke Kanan Bawah
Tabel unsur-unsur kimia ini disusun menurut nomor atom, membesar ke arah kanan bawah. Nomor atom pada tabel periodik menyatakan jumlah proton yang dimiliki, semakin ke kanan maka nomor massa atom akan semakin besar.
2. Pahami Unsur Kimia
Setiap unsur kimia pasti memiliki 1 proton lebih banyak daripada atom di sebelah kirinya. Untuk cara mengetahuinya kamu bisa melihat nomor atom yang tersusun.
Unsur-unsur kimia ini dikelompokkan menjadi 3 golongan. Misalnya, baris pertama menunjukan hidrogen dengan nomor atom 1 dan helium dengan nomor atom 2 maka kamu bisa tau bahwa kedua unsur itu terletak di ujung tabel periodik sebelah kiri dan kanan.
3. Golongan Atom dengan Kesamaan Sifat Fisik
Golongan tabel periodik ditampilkan oleh kolom vertikal dan dicirikan dengan warna yang sama. Warna ini digunakan untuk mengidentifikasi unsur-unsur dengan sifat fisik dan kimia yang mirip sehingga dapat memprediksi reaksi unsur kimia setiap golongan dengan jumlah elektron yang sama.
Unsur kimia hanya masuk dalam satu golongan, kecuali hidrogen yang masuk kelompok halogen dan logam alkali.
4. Perhatikan Ruang Kosong
Hal yang perlu kamu perhatikan selanjutnya adalah penyusunan unsur-unsur untuk memperkirakan sifat-sifat fisik dan kimia yang sama. Ini akan memudahkanmu memahami setiap unsur yang bereaksi.
Jika unsur kimia bertambah maka penggolongannya semakin sulit. Itulah mengapa ada ruang kosong pada tabel unsur-unsur kimia ini. Misalnya pada 3 baris pertama tabel terdapat ruang kosong karena berfungsi untuk logam transisi yang akan dimunculkan di tabel periodik dengan nomor atom 21.
5. Baris adalah Periode
Unsur kimia pada satu periode pasti memiliki jumlah orbital atom yang sama dan akan dilintasi oleh elektron-elektron tertentu. Jumlah orbital ini sesuai dengan jumlah periode pada tabel periodik yang sebanyak 7 baris. Misalnya unsur periode 1 memiliki 1 orbital, dan unsur periode 7 memiliki 7 orbital.
6. Bedakan Logam, Semi Logam, dan Nonlogam
Kamu perlu mengenal jenis unsurnya agar lebih mudah memahami sifat-sifat unsur pada tabel periodik. Perbedaan warna pada tabel periodik menunjukan unsur tersebut masuk kelompok logam, semi logam, atau nonlogam.
Kamu bisa melihat pembedanya untuk menemukan unsur logam di kanan tabel, unsur kimia non logam berada di bagian kiri, dan kelompok semi logam berada di antara logam dan nonlogam.
FAQ
Apa yang dimaksud tabel periodik?
Tabel periodik adalah susunan unsur kimia yang diurutkan menurut nomor atomnya agar sifat periodik kimia suatu unsur (periodisitas kimia) menjadi lebih jelas.
Apa manfaat dari tabel periodik?
Fungsi tabel periodik unsur adalah mengetahui nomor atom, konfigurasi elektron, dan mempelajari sifat-sifat unsur beserta keteraturannya.
Apa yang dimaksud 6 periode?
Periode 6 adalah salah satu kelompok elemen kimia di baris keenam pada tabel periodik unsur. Unsur di periode ini mulai cesium sampai radon.
Apakah kita harus menghafal tabel periodik?
Tabel periodik dalam kimia berfungsi seperti peta yang tidak perlu dihafal semuanya.
Baca juga artikel terkait lainnya di SemutAspal:
Dapatkan berita terbaru! Ikuti kami di Google News dan dapatkan kabar terupdate langsung di genggaman.